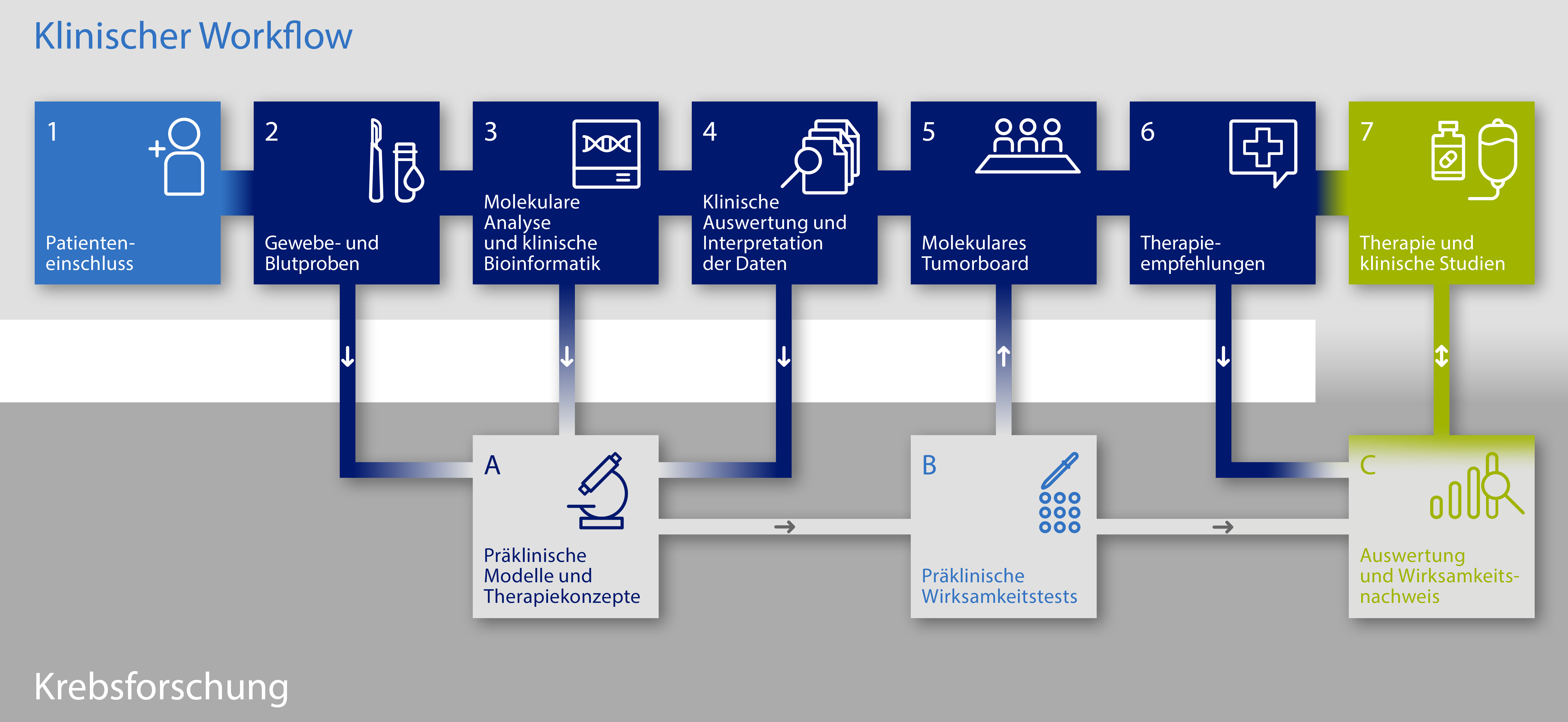
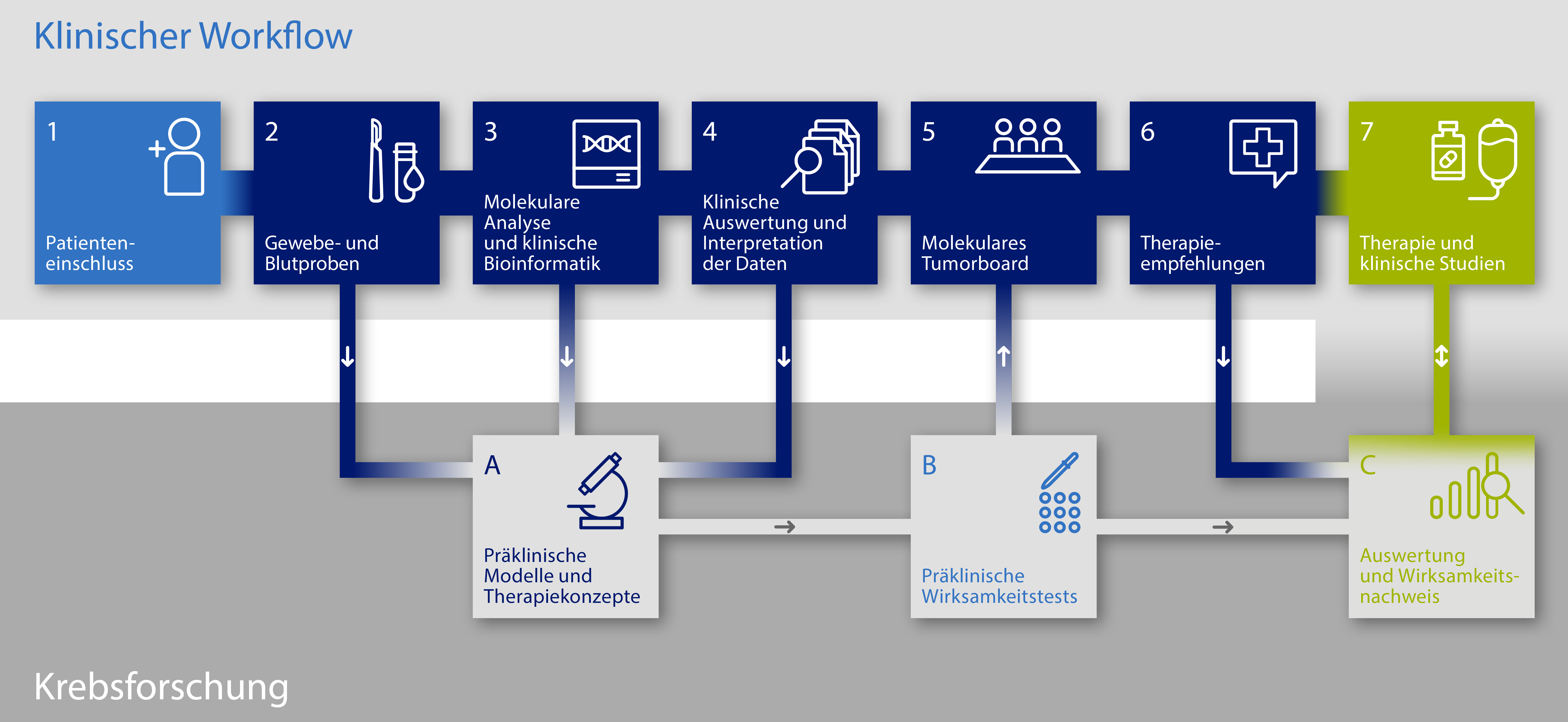
1. Aufklärung / Studieneinschluss am NCT Heidelberg
2. Gewinnung von Biomaterial (Gewebe + Blut) für die molekularen Analysen im Zuge von Standard- bzw. Routineeingriffen oder als Studien-spezifische Maßnahme:
- Tumorgewebe: Frisch-Gewebeproben (nach Möglichkeit kein Paraffin-Gewebe) als Voraussetzung für die nachgeschalteten molekular-genetischen Analysen
- Blutentnahme (Vergleichsprobe von normalen Körperzellen zur Definition von tumor-spezifischen genetischen Veränderungen)
3. Tumorzellgehalt Frischgewebe-Probe (Voraussetzung Analysen: Mindestgehalt 20% Tumorzellen)
- Evaluation von Tumor-Infiltrierenden Lymphozyten (TILs)
4. Molekulare Analysen: Tumor-Genom-Sequenzierung (DKFZ Heidelberg) / Next Generation Sequencing
- Analyt-Isolation (DNA, RNA, Protein, Sample Processing Lab, DKFZ)
- Proben-Vorbereitung für Hochdurchsatz-Sequenzierung (Genomics Core Facility, DKFZ)
- Methodik: Whole-Genome/ Whole-Exom und Transkriptom Sequenzierung
5. Diskussion molekular-genetischer Befunde im interdisziplinärem molekularen Tumorboard
- Teilnehmer: Onkologen, Bioinformatiker, Molekularbiologen, Pathologen, Humangenetiker
- Priorisierung von Therapie-relevanten Genveränderungen und molekularer Targets
- Generierung eines molekularen Reports mit therapeutischen Optionen
6. Diskussion molekular-genetischer Befunde und Prüfung möglicher Behandlungswege mit dem Patienten
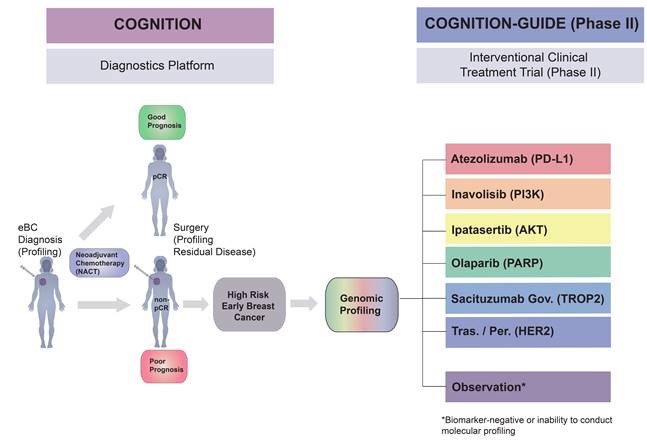
7. Biomarker-basierte, personalisierte Behandlung mit zielgerichteten Substanzen entsprechend des genetischen Tumorprofils am NCT Heidelberg (außerhalb der Register-Studie) in einer zukünftigen 9-armigen Phase II Behandlungsstudie (COGNITION-GUIDE)