Gemeinsame Pressemitteilung des Deutschen Krebsforschungszentrums (DKFZ), der Universitätsmedizin Mannheim, des Universitätsklinikums Heidelberg und des Nationalen Centrums für Tumorerkrankungen (NCT) Heidelberg
Tumorimpfungen können den Körper im Kampf gegen Krebs unterstützen. Mutationen im Tumorerbgut führen häufig zu krebstypisch veränderten Proteinen. Ein Impfstoff kann das Immunsystem der Patienten auf solche mutierten Proteine aufmerksam machen. Mediziner und Krebsforscher aus Heidelberg und Mannheim haben nun erstmals einen mutationsspezifischen Impfstoff gegen bösartige Hirntumoren in einer klinischen Studie geprüft. Die Impfung erwies sich als sicher und löste im Tumorgewebe die erwünschten Immunreaktionen aus, wie das Team nun in der Zeitschrift Nature berichtet.
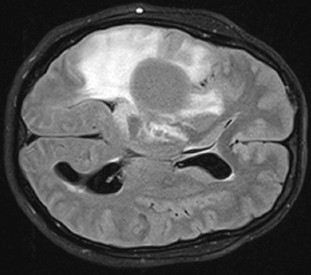
Diffuse Gliome sind meist unheilbare Hirntumoren, die sich im Gehirn ausbreiten und operativ nur schwer vollständig entfernt werden können. Auch Chemo- oder Strahlentherapie sind häufig nur begrenzt wirksam. Die diffusen Gliome haben vielfach eine besondere Gemeinsamkeit: In über 70 Prozent der Fälle tragen die Tumorzellen eine übereinstimmende Genmutation. Ein identischer Schreibfehler im Erbgut, der dazu führt, dass im Enzym IDH1* ein einziger, bestimmter Eiweißbaustein ausgetauscht wird. Dadurch entsteht eine neuartige Proteinstruktur – ein so genanntes Neoepitop, das vom Immunsystem des Patienten als fremd erkannt werden kann.
„Unsere Idee war, die Immunabwehr der Patienten zu unterstützen und mit einer Impfung gezielt auf das tumorspezifische Neoepitop aufmerksam zu machen", sagt der Studienleiter Michael Platten, Direktor der Klinik für Neurologie der Universitätsmedizin Mannheim und Abteilungsleiter im Deutschen Krebsforschungszentrum. Die IDH1-Mutation ist dafür besonders geeignet: Sie tritt hochspezifisch in den Gliomen auf und kommt in gesunden Geweben nicht vor. Außerdem ist das mutierte IDH1 ursächlich für die Entstehung der Gliome: „Das heißt, mit einer Impfung gegen das mutierte Protein packen wir das Problem an der Wurzel", erklärt der Neurologe Platten.
Präklinische Ergebnisse waren vielversprechend
Sein Team hatte bereits vor einigen Jahren den Abschnitt des IDH1-Proteins mit der charakteristischen Mutation synthetisch nachgebaut. Mit diesem mutationsspezifischen Peptid-Impfstoff ließ sich bei Mäusen das Wachstum von IDH1-mutierten Krebszellen aufhalten. 2019 wurde Platten unter anderem für diese Entdeckung mit dem Deutschen Krebspreis ausgezeichnet.
Ermutigt von diesen Ergebnissen entschieden sich die Ärzte um Platten, den mutationsspezifischen Impfstoff erstmals in einer Phase1-Studie** bei Patienten zu prüfen, die neu an einem IDH1-mutierten Gliom erkrankt waren (WHO Grad 3 und 4-Astrozytome). In die vom Nationalen Centrum für Tumorerkrankungen (NCT) Heidelberg und der Neuroonkologischen Arbeitsgemeinschaft der Deutschen Krebsgesellschaft (NOA) unterstützte Studie wurden insgesamt 33 Patienten in mehreren Zentren in Deutschland eingeschlossen. Sie erhielten die von Michael Schmitt, Leiter Zell- und Immuntherapie, Klinik für Hämatologie, Onkologie und Rheumatologie des Universitätsklinikums Heidelberg, und Stefan Stevanovic vom Institut für Immunologie der Universität Tübingen hergestellte Peptid-Impfung zusätzlich zur Standard-Therapie. Bei 30 Patienten konnten die Immunreaktionen ausgewertet werden.
Bei keinem der Geimpften beobachteten die Ärzte schwerwiegende Nebenwirkungen. Bei 93 Prozent der Patienten reagierte das Immunsystem spezifisch gegen das Impfpeptid. Das galt unabhängig vom genetischen Hintergrund des Patienten, der über die wichtigen Präsentationsmoleküle des Immunsystems, die HLA Proteine, bestimmt.
Bei einem großen Teil der Geimpften beobachteten die Ärzte eine so genannte „Pseudoprogression", ein Anschwellen des Tumors bedingt durch eine Armada einwandernder Immunzellen. Diese Patienten hatten besonders viele T-Helferzellen im Blut, deren Immunrezeptoren spezifisch auf das Impfpeptid reagierten, wie Einzelzell-Sequenzierungen ergaben. „Wir konnten außerdem nachweisen, dass die aktivierten mutationsspezifischen Immunzellen in das Hirntumorgewebe eingewandert sind", berichtet Theresa Bunse, DKFZ, die die immunologischen Analysen für diese Studien koordinierte.
84 Prozent der vollständig Geimpften lebten noch drei Jahre nach der Behandlung, bei 63 Prozent schritt das Tumorwachstum innerhalb dieses Zeitraums nicht weiter voran. Unter den Patienten, deren Immunsystem spezifisch auf die Vakzine reagiert hatte, lebten sogar 82 Prozent für drei Jahre ohne Tumorprogress.
Impfkonzept wird weiterverfolgt
„Darüber hinaus gehende Aussagen zur Wirksamkeit der Impfung können wir bei dieser frühen Studie ohne Kontrollgruppe nicht machen", erklärt Michael Platten. „Die Sicherheit und Immunogenität des Impfstoffs waren so überzeugend, dass wir das Impfkonzept in einer weiteren Phase 1-Studie fortgeführt haben." In dieser Folgestudie kombinieren die Ärzte die IDH1-Vakzine mit einer Immuntherapie, einem so genannten Checkpoint-Inhibitor. „Checkpoint-Inhibitoren wirken als Immun-Booster. Wir sehen gute Chancen, dass sie die Immunzellen noch deutlicher gegen die Gliome aktivieren." Diese Studie wird in Zusammenarbeit mit weiteren Zentren in Deutschland und mit Unterstützung durch das Deutsche Konsortium für translationale Krebsforschung (DKTK) durchgeführt.
Außerdem bereiten die Mediziner eine Studie der Phase II vor, mit der sie erstmals prüfen können, ob der IDH1-Impfstoff zu besseren Behandlungsergebnissen als die Standardtherapie allein führt. „Jedes Jahr wird bei etwa 5000 Menschen in Deutschland ein Gliom diagnostiziert, etwa 1200 davon sind diffuse Gliome mit IDH1-Mutation. Bislang können wir die Tumoren bei diesen Patienten meist nur begrenzt aufhalten. Wir sehen Chancen, mit der IDH1-Vakzine eine Behandlung zu entwickeln, die diese Tumoren wirkungsvoller und langfristig zurückdrängt", sagt Ko-Studienleiter Wolfgang Wick, Geschäftsführender Direktor der Neurologischen Universitätsklinik Heidelberg und ebenfalls Abteilungsleiter am Deutschen Krebsforschungszentrum.
* Isocitrat-Dehydrogenase 1
** Neurooncology Working Group of the German Cancer Society (NOA) trial 16, ClinicalTrials.gov Identifier NCT02454634
Michael Platten, Lukas Bunse, Antje Wick, Theresa Bunse, Lucian Le Cornet, Inga Harting, Felix Sahm, Khwab Sanghvi, Chin Leng Tan, Isabel Poschke, Edward Green, Sune Justesen, Geoffrey A. Behrens, Michael Breckwoldt, Angelika Freitag, Lisa-Marie Rother, Anita Schmitt, Oliver Schnell, Jörg Hense, Martin Misch, Dietmar Krex, Stefan Stevanovic, Ghazaleh Tabatabai, Joachim P. Steinbach, Martin Bendszus, Andreas von Deimling, Michael Schmitt, and Wolfgang Wick: A vaccine targeting mutant IDH1 in newly diagnosed glioma
Nature 2021, DOI: https://dx.doi.org/10.1038/s41586-021-03363-z
Ansprechpartnerin für die Presse:
Dr. Sibylle Kohlstädt
Deutsches Krebsforschungszentrum (DKFZ)
Strategische Kommunikation und Öffentlichkeitsarbeit Im Neuenheimer Feld 280
69120 Heidelberg
Tel.: +49 6221 42-2843
Fax: +49 6221 42-2968
E-Mail: s.kohlstaedt@dkfz.de
www.dkfz.de
Deutsches Krebsforschungszentrum (DKFZ)
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Über 1.300 Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Beim Krebsinformationsdienst (KID) des DKFZ erhalten Betroffene, interessierte Bürger und Fachkreise individuelle Antworten auf alle Fragen zum Thema Krebs. Gemeinsam mit Partnern aus den Universitätskliniken betreibt das DKFZ das Nationale Centrum für Tumorerkrankungen (NCT) an den Standorten Heidelberg und Dresden, in Heidelberg außerdem das Hopp-Kindertumorzentrum KiTZ. Im Deutschen Konsortium für Translationale Krebsforschung (DKTK), einem der sechs Deutschen Zentren für Gesundheitsforschung, unterhält das DKFZ Translationszentren an sieben universitären Partnerstandorten. Die Verbindung von exzellenter Hochschulmedizin mit der hochkarätigen Forschung eines Helmholtz-Zentrums an den NCT- und den DKTK-Standorten ist ein wichtiger Beitrag, um vielversprechende Ansätze aus der Krebsforschung in die Klinik zu übertragen und so die Chancen von Krebspatienten zu verbessern. Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft Deutscher Forschungszentren.