Heidelberger Präzisionsonkologie: Spezialisierte Programme der personalisierten Krebsmedizin
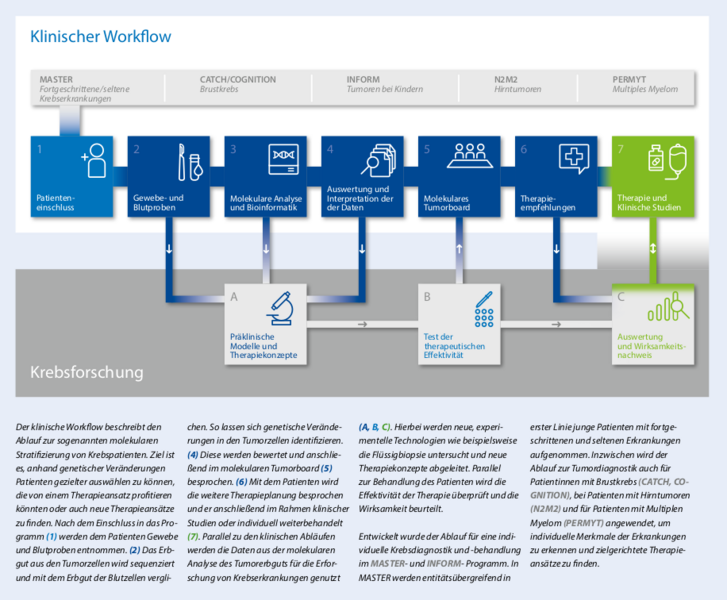
Die Wissenschaftler des Nationalen Centrums für Tumorerkrankungen (NCT), des Deutschen Krebsforschungszentrums (DKFZ) und des Universitätsklinikums Heidelberg (UKHD) erforschen schon heute die Zukunft der Onkologie – für eine personalisierte Krebsmedizin. An vorderster Linie stehen dabei unterschiedliche Forschungsprogramme. Grundlage ist die molekulare Diagnostik, welche am Standort Heidelberg seit mehreren Jahren fest verankert ist.
Seltene und fortgeschrittene Erkrankungen: MASTER-Programm
„Das vom NCT Heidelberg und vom Deutschen Konsortium für Translationale Krebsforschung (DKTK) aufgelegte MASTER-Programm ist eine zentrale Plattform für die multidimensionale Charakterisierung junger Erwachsener mit fortgeschrittenen Krebserkrankungen und Patienten mit seltenen Tumoren“, sagt Professor Stefan Fröhling, Geschäftsführender Direktor am NCT Heidelberg und Leiter der Abteilung Translationale Medizinische Onkologie am DKFZ. MASTER steht für die englische Formulierung „Molecularly Aided Stratification for Tumor Eradication“.
Das übergeordnete Ziel des Programms ist es, Patienten, bei denen die Möglichkeiten der Standardtherapie ausgeschöpft sind, eine effektive maßgeschneiderte Therapie zu ermöglichen. Dafür bedarf es der molekularen, zellulären und funktionellen Charakterisierung von individuellen Tumoren mithilfe tiefer interdisziplinärer Diagnostik. Das MASTER Programm erfolgt daher in enger Zusammenarbeit zwischen Ärzten und Wissenschaftlern der beteiligten Partnereinrichtungen des NCT Heidelberg und Dresden und den Standorten des DKTK.
„Mit Stand März 2020 haben wir circa 2.000 Patienten des MASTER-Programms mit Tumoren im fortgeschrittenen Stadium im molekularen Tumorboard besprochen. „Derzeit sind wir in etwa 80 Prozent der Fälle in der Lage, aus den Daten evidenzbasierte Empfehlungen für das weitere Management der Erkrankung betroffener Patienten abzuleiten“, fasst Fröhling zusammen. Das MASTER-Programm war Pionier, um personalisierte Ansätze der Krebsmedizin im klinischen Alltag zu etablieren. Inzwischen wird der Ablauf zur Tumordiagnostik für Klinik und Forschung auch für Patienten unterschiedlichster Krebserkrankungen genutzt.
Brustkrebs: CATCH und COGNITION
Bei der CATCH -Studie (CATCH steht für „Comprehensive Assessment of Clinical Features and Biomarkers To Identify Patients with Advanced or Metastatic Breast Cancer for Marker Driven Trials in Humans“) geht es um personalisierte Behandlungsansätze bei Brustkrebs. Dabei gilt: Jede Brustkrebserkrankung ist an sich einzigartig und es gibt nachweisbare Unterschiede im molekularen Muster. „Basis dieser Vielfalt ist die Vielzahl genetischer Mutationsmöglichkeiten, die zu einer Krebserkrankung führen können“, weiß Professor Andreas Schneeweiss, Leiter der Sektion Gynäkologische Onkologie am NCT Heidelberg. „Welche dieser Möglichkeiten tatsächlich beteiligt sind, unterscheidet sich von Patientin zu Patientin ganz individuell.“ Die genetischen Veränderungen entscheiden letztlich darüber, welche Prognose der Krebs hat und welche Behandlungsmöglichkeiten überhaupt wirksam eingesetzt werden können.
Um die infrage kommenden Genveränderungen aufzudecken, wird das genetische Profil des Tumors ermittelt. Die davon abgeleitete Behandlungsempfehlung geht meist über die bereits erprobte Standardtherapie hinaus und schließt dann ebenso Wirkstoffe ein, die derzeit für die Behandlung anderer Erkrankungen eine Zulassung erhalten haben. Innovative Therapieverfahren werden zusätzlich in weiterführenden Studien erprobt.
Für die CATCH-Studie geeignete Brustkrebspatientinnen haben in der Regel eine fortgeschrittene Erkrankung. In der COGNITION Studie (COGNITION steht für „Comprehensive assessment of clinical features, genomics and further molecular marker to identify patients with early breast cancer for enrolment on marker driven trials“) beschreiten die Mediziner einen weltweit einzigartigen Weg: Den Einsatz der personalisierten Tumortherapie schon bei Patientinnen mit frühen, potenziell heilbaren Stadien eines Brustkrebses, die trotz Standardtherapie weiterhin ein hohes Rückfall- und Sterberisiko haben. Das Ziel dieses Projekts ist somit nicht die Verbesserung der Krankheitskontrolle einer nicht mehr heilbaren Erkrankung, sondern die Verbesserung der Heilungschancen. Patientinnen mit neu diagnostiziertem Brustkrebs und einem hohen Rückfall- und Sterberisiko werden gegenwärtig neoadjuvant, das heißt vor der Operation mit einer Chemotherapie behandelt. Bei der Operation zeigt sich dann, ob das Maximalziel erreicht wurde und der Tumor komplett verschwunden ist. Dies ist mittlerweile bei circa 60 Prozent der Patientinnen der Fall. Etwa 40 erreichen aber nur eine teilweise oder keine Remission. Diese Patientinnen haben weiterhin ein hohes Rückfall- und Metastasierungsrisiko. Anhand des Tumorgewebes, das bei der Operation entfernt wird, wird ein genetisches Profil erstellt. Hiervon können zielgerichtete Therapien abgeleitet werden, die eine hohe Wirksamkeit versprechen, da sie die Therapieresistenzen der noch vorhandenen Tumorzellen berücksichtigen. Diese personalisierten Therapien werden ab Ende 2020 in der COGNITION-GUIDE Studie (GUIDE steht für „Genomics guided targeted postneoadjuvant therapy in patients with early breast cancer“) ermöglicht. Seit April 2019 wurden am NCT Heidelberg bereits über 190 Patienten in die COGNITION Studie aufgenommen. Bei 15 dieser Patienten ist eine personalisierte, zielgerichtete Therapie geplant.
N2M2: Hirntumor-Studie
„Hirntumoren, insbesondere Glioblastome gehören zu den aggressivsten und oft therapieresistenten Tumoren des Menschen. Bei ihnen zeigt der sogenannte Methylierungsstatus einzelner Gene zum einen eine korrekte molekulare Subgruppierung zum anderen hilft er das Therapieansprechen vorherzusagen", führt Professor Wolfgang Wick, Ärztlicher Direktor der Neurologie und Poliklinik am UKHD, aus.
Die Methylgruppen, bestehend aus einem Kohlenstoff und drei Wasserstoffatomen sind ein sehr stabiler und für die Kontrolle der Zellfunktion wichtiger Regulationsmechanismus des Erbguts. In der achtarmigen Studie N2M2 (die Abkürzung steht für „Neuro Master Match”) werden Patienten individuell mit einer von acht zielgerichteten Behandlungsmöglichkeiten therapiert. Voraussetzung für die Studienteilnahme ist die Aktivität in einem Eiweiß, das zu einer Resistenz gegen alkylierende Chemotherapie führt. Die Therapieentscheidung basiert auf der Analyse verschiedener Methylierungsmuster und der Genaktivität. Für etwa 60 Prozent der Patienten mit neu diagnostizierten Glioblastomen wird in dieser multizentrisch durchgeführten Studie eine molekularbasierte Behandlungsstrategie umgesetzt.
Multiples Myelom
Ebenso bietet die Myelomforschung Ansätze für die molekulare Tumordiagnostik. Das Multiple Myelom gehört zu den komplexeren und sehr heterogenen hämatologischen Krebserkrankungen. Die zugrundeliegenden Mechanismen, die letztlich die Tumorentstehung fördern, sind größtenteils noch unverstanden. „Ziel der translationalen Myelomforschung in Heidelberg ist es, diese komplexe Biologie des Myeloms besser zu verstehen. Erkenntnisse zur Entstehung, dem Fortschreiten sowie der Resistenzbildung bieten eine gute Grundlage, um neue Möglichkeiten der Tumorbehandlung und nicht zuletzt auch neue Zielstrukturen für Medikamente daraus abzuleiten“, berichtet Professor Marc-Steffen Raab, der gemeinsam mit Dr. Niels Weinhold die Arbeitsgruppe Translationale Myelomforschung am DKFZ und UKHD leitet.
„Um tiefere Einblicke in die Heterogenität des Multiplen Myeloms im Krankheitsverlauf zu erhalten, stehen unsere Arbeitsgruppen mit vielen weiteren Partnern verschiedenster Fachdisziplinen im Austausch, beispielsweise aus Humangenetik, Molekularbiologie, Immunologie, Informatik und Pathologie“, ergänzt Professor Hartmut Goldschmidt, Leiter des Heidelberger Myelomschwerpunkts, eine Sektion der Medizinischen Klinik V und eine gemeinsame Initiative des UKHD und des NCT Heidelberg.
Das Programm PERMYT (die Abkürzung steht für „Personalizing Refractory Myeloma Therapy“), richtet sich an Patienten, die in einem späteren Krankheitsstadium nicht mehr auf etablierte Therapien ansprechen. Auf Basis einer tiefen Diagnostik werden maßgeschneiderte Behandlungsstrategien für diese Patienten entwickelt.
Alle Daten und Ergebnisse der molekularbiologischen Diagnostik im Rahmen der Myelomforschung werden gemeinsam mit den Bioinformatikern des DKFZ ausgewertet und interpretiert. „Durch die Kombination von Methoden aus Informatik, Bioinformatik und Statistik sind wir heute in der Lage, beispielsweise Netzwerke genetischer Regulationen zu beschreiben und auch detaillierter zu untersuchen“, erklärt Professor Benedikt Brors, Leiter der Abteilung für Angewandte Bioinformatik am DKFZ.
Kinder mit Krebs: INFORM-Studie
Obgleich Krebs im Kindesalter nicht selten eine gute Prognose hat und heutzutage bis zu 75 Prozent der kleinen Patienten geheilt werden, tragen dennoch einige Kinder ein erhöhtes Rezidivrisiko mit deutlich schlechterer Prognose.
„Um zukünftig auch diesen Kindern verbesserte Therapiemöglichkeiten anbieten zu können, wurde das INFORM-Programm ins Leben gerufen“, sagt Professor Stefan Pfister, Direktor am Hopp-Kindertumorzentrums Heidelberg (KiTZ), Abteilungsleiter für Pädiatrische Neuroonkologie am DKFZ und Oberarzt der Klinik für Pädiatrische Onkologie, Hämatologie und Immunologie am UKHD. INFORM steht für „INdividualized Therapy FOr Relapsed Malignancies in Childhood“. „Das Prinzip des INFORM-Registers basiert auf der molekularen Charakterisierung von Rezidiven der zwölf wichtigsten kindlichen Tumorarten, für die es zumeist keine weitere adäquate Standardtherapieoption mehr gibt.“
Mithilfe der Sequenzierung werden genetische „Fingerabdrücke“ der Tumoren erstellt und die Daten anschließend den behandelnden Onkologen zur Verfügung gestellt. Diese werten die Ergebnisse dann im interdisziplinären molekularen Tumorboard aus und leiten mögliche Therapieoptionen daraus ab. So wird beispielsweise aktuell im Teilprogramm INFORM2 an neuartigen innovativen Kombinationstherapien und deren Anwendbarkeit bei Rezidiven kindlicher Tumoren geforscht.