Translationale Forschung zu extrazellulären Vesikeln
Extrazelluläre Vesikel und molekulare Signaltransduktion in der Onkologie
Nachwuchsgruppe - Leitung: Dr. med. Antonia Schubert
Extrazelluläre Vesikel (EVs) sind zentrale Mediatoren der interzellulären Kommunikation und spielen eine wichtige Rolle in der Tumorbiologie –von der Signalübertragung über die Tumor-Stroma-Interaktion bis hin zur Metastasierung. Ihr großes Potenzial als Biomarker und therapeutische Vehikel wird bislang durch komplexe Isolationsverfahren und ein unzureichendes Verständnis ihrer biologischen Funktion limitiert.
Unsere Forschungsgruppe verbindet molekulare Grundlagenforschung mit translationaler Onkologie, um die Rolle von EVs in der Signalwegstransduktion systematisch zu untersuchen. Zentrale Herausforderungen der EV-Forschung adressieren wir in drei komplementären Forschungsschwerpunkten:
- Wir untersuchen die Mechanismen der EV-vermittelten Signalwegsaktivierung sowie den Einfluss von Signalwegsmutationen auf die EV-Sekretion und Tumor-Stroma-Interaktion.
- In einem translationalen Ansatz analysieren wir Patient:innen-EVs um den Einsatz von EVs als diagnostische und prognostische Biomarker zu evaluieren.
- Durch die gezielte Veränderung von EVs (EV-Engineering) soll eine gerichtete Lieferung therapeutischer Wirkstoffe untersucht werden.
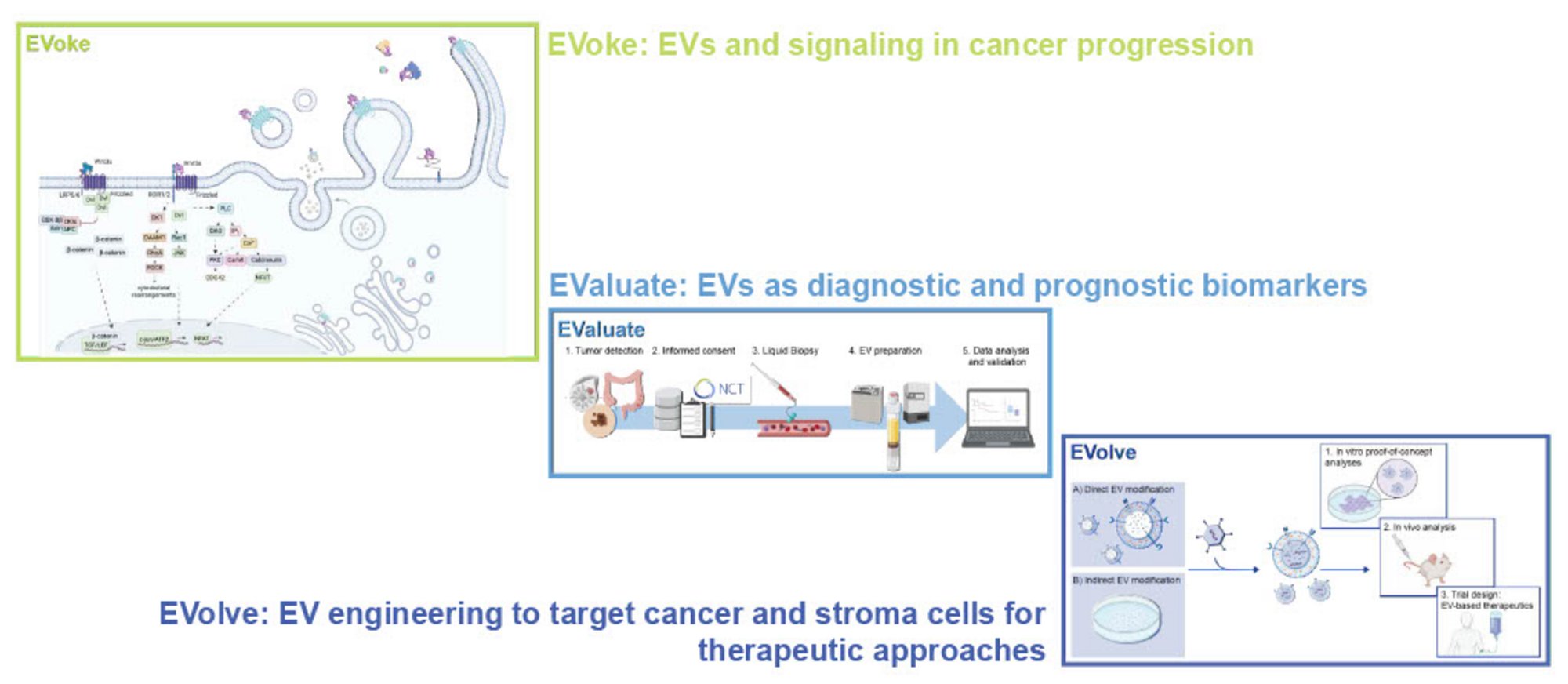
Überblick unserer EV-basierten Untersuchungen. Copyright: A. Schubert – Erstellt mit BioRender.com
Im Mittelpunkt unserer mechanistischen Untersuchungen steht dabei der Wnt-Signalweg, der maßgeblich an Tumorentstehung, Progression und Therapieresistenz beteiligt ist –unter anderem im kolorektalen Krebs, hepatozellulären Karzinom und Brustkrebs. Wir interessieren uns für den Einfluss des Mikrobioms auf die Wnt-regulierten Signalwege sowie der Rolle von EVs in der komplexen Interaktion zwischen Tumor, Mikrobiom und therapeutischen Interventionen. Neben der extrazellulären Signalübertragung über EVs untersuchen wir die intrazelluläre Weiterleitung von Wnt Signalen, die wir mithilfe von Genome Engineering und fortschrittlicher Bildgebungsmethoden gezielt funktionell untersuchen.
Unsere Forschung ist in ein starkes grundlagenwissenschaftliches Netzwerk eingebunden, das Kooperationen mit Gruppen der Universität Heidelberg, der Universitätsmedizin Mannheim und Göttingen, der Eidgenössischen Technischen Hochschule Zürich (ETH Zürich) sowie dem Europäischen Laboratorium für Molekularbiologie (EMBL) umfasst. Durch die enge Anbindung an das Deutsche Krebsforschungszentrum (DKFZ) und das Nationale Centrum für Tumorerkrankungen (NCT) Heidelberg schaffen wir gleichzeitig die Voraussetzungen, um präklinische Erkenntnisse in klinische Studien zu überführen und so die translationale Anwendung unserer Ansätze in der personalisierten Krebsmedizin voranzutreiben. Ziel ist es, extrazelluläre Vesikel (EVs) als Schlüsseltechnologie in der personalisierten Onkologie zu etablieren.
Extrazelluläre Vesikel, Liquid Biopsy, Wnt-Signalwege, Mikrobiom, Genom- und EV-Engineering, Präzisionsonkologie
| 2025 | Deutsche Krebshilfe – Mildred Scheel Promotionsstipendium (L. Schik, zusammen mit M. Boutros) |
| 2023 | SFB1324 Innovation Fund: “Compositional regulation of Wnt-signaling dependent biomolecular condensates” (A. Schubert) |
| 2023 | Else Kröner-Fresenius-Stiftung – Projektförderung: "EValuate: Charakterisierung extrazellulärer Vesikel als diagnostische und prognostische Biomarker” (A. Schubert) |
| 2022 | DKFZ-MOST-Programm (N. Winkler, zusammen mit M. Boutros) |
| 2021 | DKFZ Clinician Scientist Program (A. Schubert) |
| 2018/2019 | Stipendium “Kolleg für Translationale Medizin“, Universitätsmedizin Göttingen (A. Schubert) |
| 2012 | “Gö4med“ MD Stipendium, Universitätsmedizin Göttingen (A. Schubert) |
| 2024 | DKTK Travel Grant (A. Schubert) |
| 2022 | EMBO Posterpreis, Wnt Conference Awaji, Japan: “Super-resolution microscopy localizes endogenous Dvl2 to Wnt signaling-responsive biomolecular condensates” (A. Schubert) |
| 2021 | DKTK School of Oncology Fellowship (A. Schubert) |
| 2016 | Posterpreis, Deutsche Gesellschaft für Hämatologie und Onkologie, Leipzig: “DVL3 in breast cancer and tumor progression“ (A. Schubert) |
Schubert A, Heigwer F, Scheeder C, Voloshanenko O, Kranz D, Ragaller F, Winkler N, Miersch T, Schmitt B, Kuhse M, Gimenes D, Ordoñez-Rueda D, Schwarz J, Stein F, Jäger D, Engel U, Boutros M. Image-based screens identify regulators of endogenous Dvl2 biomolecular condensates. BioRxiv. 2025 Jan 11:632522. doi: 10.1101/2025.01.11.632522. Preprint.
Schubert A, Mongkolsittisilp A, Kobitski A, Schulz M, Voloshanenko O, Schaffrinski M, Winkler N, Neßling M, Richter K, Kranz D, Nienhaus K, Jäger D, Trümper L, Büntzel J, Binder C, Nienhaus GU, Boutros M. WNT5a export onto extracellular vesicles studied at single-molecule and single-vesicle resolution. FEBS J. 2025. Accepted.
Irmer B, Efing J, Reitnauer LE, Angenendt A, Heinrichs S, Schubert A, Schulz M, Binder C, Tio J, Hansen U, Geyer C, Gerwing M, Bleckmann A, Menck K. Extracellular vesicle-associated tyrosine kinase-like orphan receptors ROR1 and ROR2 promote breast cancer progression. Cell Commun Signal. 2023 Jul 10;21(1):171. doi: 10.1186/s12964-023-01186-1. PMID: 37430307; PMCID: PMC10331971.
Schubert A, Voloshanenko O, Ragaller F, Gmach P, Kranz D, Scheeder C, Miersch T, Schulz M, Trümper L, Binder C, Lampe M, Engel U, Boutros M. Superresolution microscopy localizes endogenous Dvl2 to Wnt signaling-responsive biomolecular condensates. Proc Natl Acad Sci U S A. 2022 Jul 26;119(30):e2122476119. doi: 10.1073/pnas.2122476119. Epub 2022 Jul 22. PMID: 35867833; PMCID: PMC9335300.
Walle T, Bajaj S, Kraske JA, Rösner T, Cussigh CS, Kälber KA, Müller LJ, Strobel SB, Burghaus J, Kallenberger SM, Stein-Thöringer CK, Jenzer M, Schubert A, Kahle S, Williams A, Hoyler B, Zielske L, Skatula R, Sawall S, Leber MF, Kunes RZ, Krisam J, Fremd C, Schneeweiss A, Krauss J, Apostolidis L, Berger AK, Haag GM, Zschäbitz S, Halama N, Springfeld C, Kirsten R, Hassel JC, Jäger D; NCT ANTICIPATE Investigators, Ungerechts G. Cytokine release syndrome-like serum responses after COVID-19 vaccination are frequent and clinically inapparent under cancer immunotherapy. Nat Cancer. 2022 Jun 17. doi: 10.1038/s43018-022-00398-7. Epub ahead of print. Erratum in: Nat Cancer. 2022 Jul 15: PMID: 35715501.
Schubert A, Boutros M. Extracellular vesicles and oncogenic signaling. Mol Oncol. 2021 Jan;15(1):3-26. doi: 10.1002/1878-0261.12855. Epub 2020 Dec 6. PMID: 33207034; PMCID: PMC7782092.
Bleckmann A, Conradi LC, Menck K, Schmick NA, Schubert A, Rietkötter E, Arackal J, Middel P, Schambony A, Liersch T, Homayounfar K, Beißbarth T, Klemm F, Binder C, Pukrop T. β-catenin-independent WNT signaling and Ki67 in contrast to the estrogen receptor status are prognostic and associated with poor prognosis in breast cancer liver metastases. Clin Exp Metastasis. 2016 Apr;33(4):309-23. doi: 10.1007/s10585-016-9780-3. Epub 2016 Feb 9. PMID: 26862065; PMCID: PMC4799797.
Antonia Schubert (Gruppenleiterin)
Nadine Winkler (PhD Studierende, zusammen mit M. Boutros)
Tami Gibson (MD Studierende)
Lukas Schik (MD Studierender)
N.N. (MTA)







